 Заведующий лабораторией генетической инженерии растений
Заведующий лабораторией генетической инженерии растенийКонстантинов Юрий Михайлович, д.б.н., профессор
e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Лаборатория основана в 1989 году (с 1982 года существовала в статусе группы генетической инженерии растений).
В центре основных научных интересов лаборатории генетической инженерии растений Сибирского института физиологии и биохимии растений СО РАН находится проблема взаимодействия трех геномов растительной клетки (митохондриального, хлоропластного и ядерного) в ходе жизненного цикла высших растений, а также проблема разработки принципов направленного изменения генома митохондрий. Исследования ведутся по следующим направлениям:
- Редокс-регуляция экспрессии генов как способ интеграции трех геномов растительной клетки в единую генетическую систему.
- Исследование молекулярных механизмов импорта ДНК в митохондрии и разработка систем генетической трансформации митохондрий растений in vivo
Коллектив лаборатории обладает необходимыми навыками, опытом и квалификацией для проведения работ с культурами растительных клеток и целыми растениями, изучения экспрессии генов методами количественной ОТ-ПЦР и ДНК-микрочипирования (microarray), выделения митохондрий и хлоропластов из различных источников и работы с интактными органеллами, клонирования ДНК, анализа нуклеиновых кислот и белков методами электрофореза в нативных и денатурирующих условиях, в том числе методом Blue Native PAGE при исследованиях белковых комплексов.
РЕДОКС-РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ КАК СПОСОБ ИНТЕГРАЦИИ ТРЕХ ГЕНОМОВ РАСТИТЕЛЬНОЙ КЛЕТКИ В ЕДИНУЮ ГЕНЕТИЧЕСКУЮ СИСТЕМУ
Обнаружена зависимость экспрессии ядерного гена gdh2, кодирующего бета-субъединицу митохондриальной глутаматдегидрогеназы, от редокс-состояния электрон-транспортной цепи митохондрий. Обработка суспензионной культуры клеток арабидопсиса ингибиторами митохондриальных дыхательных комплексов III и IV приводит к увеличению содержания транскриптов gdh2, в то время как ингибирование комплекса I не оказывает какого-либо воздействия на экспрессию данного гена. Таким образом, установлено, что экспрессия гена gdh2 реагирует на изменения редокс-состояния дыхательной цепи на участке, локализованном между первым и третьим дыхательным комплексом. При этом фосфорилирование белков, осуществляемое серин-треониновыми протеинкиназами, является необходимым этапом в процессе передачи сигнала об изменении экспрессии gdh2 (Тарасенко и др., 2009).
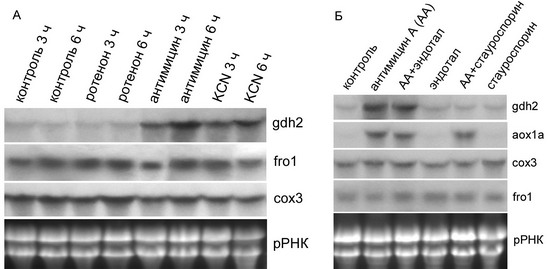
(A) Влияние ингибиторов трех комплексов дыхательной цепи митохондрий – ротенона (комплекс I), антимицина А (комплекс III) и цианида калия (комплекс IV) – на содержание транскриптов гена gdh2 в суспензии клеток арабидопсиса.
(Б) Влияние ингибиторов протеинкиназ (стауроспорин) и протеинфосфатаз (эндотал) на индукцию гена gdh2, а также гена альтернативной оксидазы aox1a, под воздействием антимицина А. Уровень транскриптов генов сох3 и fro1 приведен в качестве контроля.
Показано, что экспрессия генов gdh1 и gdh2 зависит также и от хлоропластно-ядерных сигналов. При переносе растений арабидопсиса из темноты на свет, экспрессия генов gdh1 и gdh2 многократно снижается. Обработка листьев ингибитором транспорта электронов DCMU, приводящая к окислению пула пластохинона тилакоидных мембран на свету, вызывает повышение экспрессии генов gdh1 и gdh2 подобно тому, как это происходит в темноте. Таким образом, в регуляции экспрессии генов gdh1 и gdh2 принимают участие сигналы, возникающие при изменении редокс-состояния пула хлоропластного пластохинона.
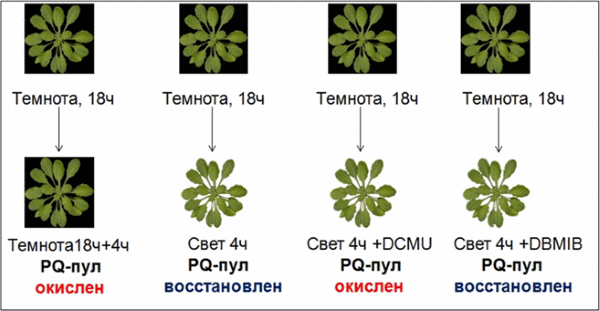
Схема экспериментов по изучению влияния редокс-состояния пула пластохинона на экспрессию генов gdh1 и gdh2. PQ-пул – пул пластохинона. DCMU – 3-(3,4-дихлорофенил)-1,1-диметилмочевина (20 мМ). DBMIB – 2,5-дибромо-3-метил-6-изопропилбензохинон (200 мМ).
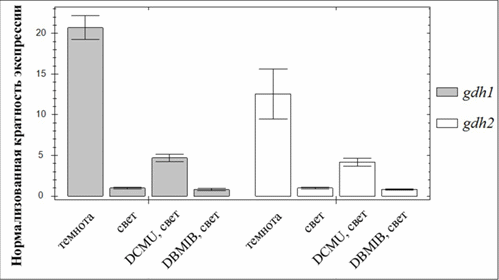
Экспрессия генов gdh1 и gdh2 в листьях растений арабидопсиса зависит от изменения редокс-состояния пула пластохинона в хлоропластах. Представлены результаты обратно-транскриптазной ПЦР в реальном времени. Для нормализации использовали уровень транскрипта гена YLS8.
Обнаружено, что редокс-условия оказывают комплексное воздействие на генетические процессы в митохондриях. Показано существование редокс-контроля транскрипции и трансляции в митохондриях высших растений (Konstantinov et al., 1995; Гарник и др., 2006). С помощью метода run-on транскрипции в митохондриях исследовано влияние редокс-состояния основного и альтернативного путей переноса электронов на транскрипцию митохондриальных генов в растениях Arabidopsis thaliana. Обнаружено, что ингибиторы цитохромного пути (антимицин А, KCN) и альтернативной оксидазы (салицилгидроксамовая кислота - СГК) оказывают разнонаправленный эффект на скорость транскрипции митохондриальных генов: если ингибирование основного пути переноса электронов в митохондриях приводит к существенному снижению скорости транскрипции, то при ингибировании альтернативной оксидазы наблюдается увеличение скорости транскрипции генов (Zubo et al., 2014). Таким образом, ингибирование потока электронов по цитохромному пути может служить редокс-сигналом для репрессии транскрипции митохондриальных генов, в то время как усиление потока электронов, происходящее при ингибировании альтернативного пути окисления, вызывает активацию транскрипции.
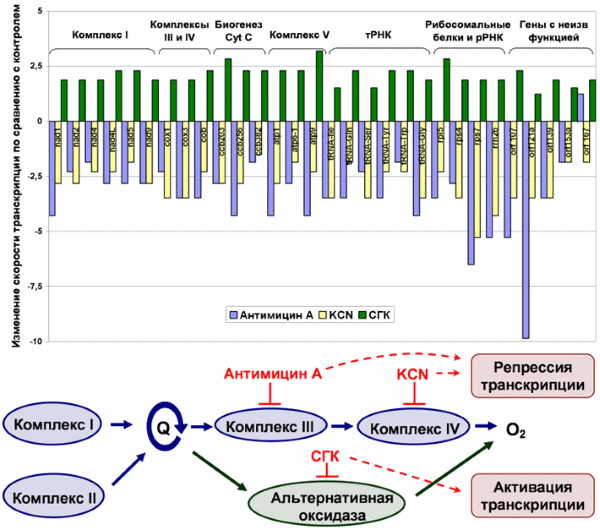
Разнонаправленный эффект ингибиторов цитохромного пути и альтернативной оксидазы на скорость транскрипции митохондриальных генов Arabidopsis thaliana. Схема иллюстрирует места действия ингибиторов дыхания. СГК – салицилгидроксамовая кислота.
С помощью метода run-on транскрипции в хлоропластах исследовано влияние редокс-состояния основного и альтернативного путей переноса электронов митохондрий на транскрипцию хлоропластных генов в растениях Arabidopsis thaliana. Показано, что изменение состояния основного пути транспорта электронов при обработке растений арабидопсиса ингибитором митохондриального дыхательного комплекса IV цианидом калия приводит к снижению скорости транскрипции хлоропластных генов. Ингибирование альтернативного пути дыхания митохондрий с помощью салицилгидроксамовой кислоты также вызывает некоторое снижение интенсивности транскрипции. Одновременное ингибирование основного и альтернативного путей дыхания митохондрий приводит к существенно более выраженному подавлению транскрипции хлоропластных генов (Зубо и др., 2014).
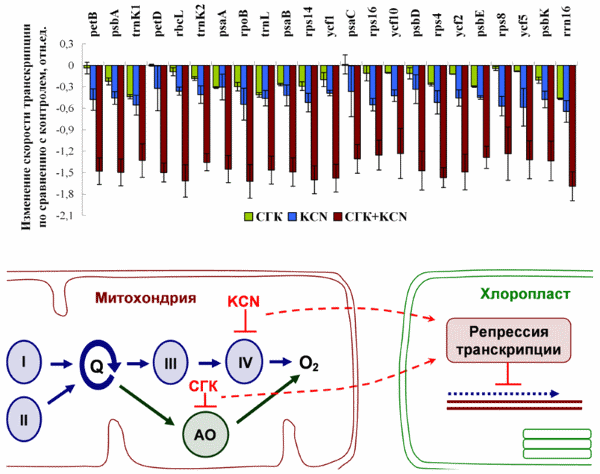
Изменение интенсивности транскрипции хлоропластных генов в растениях арабидопсиса, обработанных ингибитором альтернативного пути дыхания салицилгидроксамовой кислотой (СГК), ингибитором основного пути цианидом калия (KCN), либо их смесью. Римскими цифрами обозначены комплексы дыхательной цепи. АО – альтернативная оксидаза..
Важно отметить, что снижение транскрипции наблюдается только в условиях освещения и полностью отсутствует в темноте. Данный факт указывает на вероятную роль подобной регуляции транскрипции в предотвращении сверхвосстановленного состояния хлоропластов на свету. Полученные результаты свидетельствуют в пользу существования механизма регуляции транскрипции хлоропластных генов, воспринимающего редокс-сигналы от основного и альтернативного путей переноса электронов митохондрий. Такой механизм может иметь важное физиологическое значение в оптимизации фотосинтеза высших растений.
ИССЛЕДОВАНИЕ МОЛЕКУЛЯРНЫХ МЕХАНИЗМОВ ИМПОРТА ДНК В МИТОХОНДРИИ И РАЗРАБОТКА СИСТЕМ ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ МИТОХОНДРИЙ РАСТЕНИЙ IN VIVO
Сотрудниками лаборатории впервые установлено, что изолированные митохондрии способны импортировать двухцепочную линейную ДНК путем активного, не зависящего от последовательности ДНК транспорта. Способностью к импорту ДНК обладают митохондрии, изолированные не только из разных растительных объектов (картофель, кукуруза, арабидопсис, цветная капуста, суспензионная культура клеток табака), но и млекопитающих (печень крысы, культура клеток человека) (Koulintchenko et al., 2003, Koulintchenko et al., 2006, Константинов и др., 2016). Эффективность импорта ДНК в митохондрии зависит как от физической формы молекулы (линейные молекулы транспортируются намного эффективнее, чем кольцевые), так и от ее размера (с увеличением длины импортируемого субстрата импорт эффективность импорта снижается). Показано, что чужеродный генетический материал (а именно ген GFP), импортируемый в органеллы в составе вектора, созданного на основе кукурузного плазмидного репликона, контролируемый митохондриальными регуляторными последовательностями, может экспрессироваться, а также служить матрицей для синтеза ДНК. Наличие регуляторных митохондриальных последовательностей для синтеза как РНК, так и ДНК, при этом является критическим.
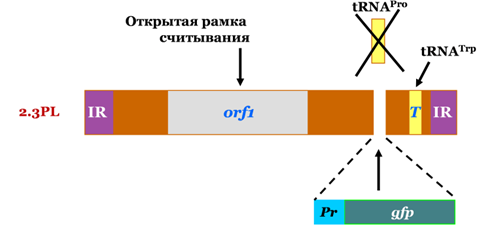
Схематическая организация генетической конструкции на основе митохондриальной плазмиды 2,3 т.п.н. кукурузы, использованной в качестве субстрата для импорта в митохондрии.
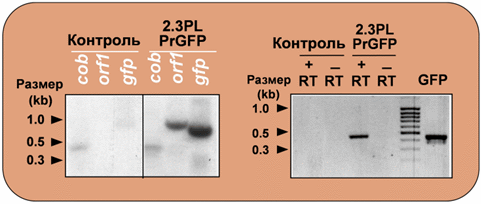
Транскрипция импортируемой ДНК в растительных митохондриях. Экспрессия генов orf1 и gfp в растительных митохондриях показана методом транскрипции in organello с последующей Southern-блот гибридизацией (A) и обратно-транскриптазной ПЦР (Б).
При исследовании механизма транспорта ДНК в растительные митохондрии установлено, что в этом процессе участвуют белки наружной и внутренней мембран органелл. С использованием антител, специфичных к белку наружной митохондриальной мембраны порину, показана необходимость этого белка для осуществления транспорта ДНК в митохондрии. Ингибиторный анализ с применением таких специфичных к белку-переносчику АДФ и АТФ в митохондриях лигандов, как атрактилозид и бонгкрековая кислота, продемонстрировал, что основным белком внутренней митохондриальной мембраны, участвующим в транспорте ДНК, является адениннуклеотидтранслоказа. Сделано заключение о том, транспорт ДНК через митохондриальную мембрану является энергозависимым процессом и происходит с участием порина в наружной митохондриальной мембране и адениннуклеотидтранслоказы во внутренней митохондриальной мембране (Koulintchenko et al., 2003). В более поздних исследованиях было показано, что этими белками механизм импорта ДНК не исчерпывается, и в транслокации ДНК участвует ряд других белковых кофакторов, в частности Cu-связывающий белок (CuBP) в составе дыхательного комплекса I растительных митохондрий (Weber-Lotfi et al., 2015).
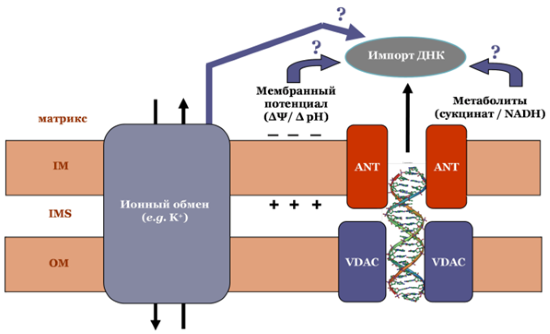
Компоненты предполагаемого механизма транслокации ДНК в растительные митохондрии. ANT – адениннуклеотидтранслоказа. VDAC – митохондриальный порин.
С участием сотрудников лаборатории впервые получены доказательства интеграции чужеродной ДНК в митохондриальный геном картофеля, осуществляемой по механизму гомологичной рекомбинации (Mileshina et al., 2011). Установлено, что (1) ген-репортер может быть интегрирован в мтДНК без дупликаций и делеций; (2) рекомбинация происходит по фланкирующим ген-репортер последовательностям; (3) для обмена гомологичными последовательностями необходимо наличие фланкирующих ген-репортер последовательностей длиной 0,5-0,6 т.п.н., гомологичных резидентной мтДНК; (4) рекомбинационный процесс не требует жесткой гомологии между встраиваемой последовательностью и мтДНК. В последующем обнаружено, что импорт ДНК-субстратов больших размеров зависит от наличия в их последовательности определенных элементов, а именно, инвертированных повторов на 5’- и 3’-концах молекулы: известно, что внутри органелл инвертированные повторы вовлечены в связывание с белками, участвующими в репликации и стабилизации плазмиды (Ibrahim et al., 2011). При этом эффективность импорта ДНК в митохондрии млекопитающих не зависит от последовательности молекулы.
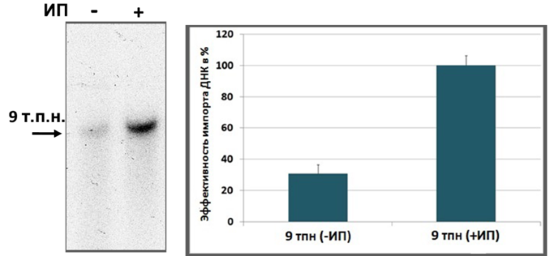
ДНК-субстрат большой длины (9 т.п.н.), содержащий на концах инвертированные повторы (ИП), импортируется в митохондрии картофеля со значительно более высокой эффективностью.
Наличие природного механизма переноса ДНК в митохондрии открывает принципиально новые возможности как для фундаментальных исследований в области молекулярной биологии митохондриальных генов, так и для научно-прикладных исследований по разработке подходов и методов митохондриальной трансформации для решения задач в биомедицине, биотехнологии и сельском хозяйстве.
Генетическая трансформация митохондрий растений является важной и до настоящего времени нерешенной задачей. Один из возможных подходов к ее решению - использование растений с инактивированной РНК-полимеразой RPOTmp. Данный белок участвует в контроле экспрессии как митохондриальных, так и хлоропластных генов, а мутантные по нему растения характеризуются рядом фенотипических и молекулярно-биологических отличий, таких как замедленный рост, изменения в морфологии листьев, экспрессии митохондриальных и, возможно, хлоропластных генов, пониженная активность митохондриальных дыхательных комплексов. Целью исследований лаборатории является выяснение специфической роли, которую RPOTmp играет в митохондриях и хлоропластах. С помощью агробактериальной трансформации мутантной линии арабидопсиса rpotmp получены трансгенные растения, в которых белок RPOTmp направляется либо только в митохондрии, либо только в хлоропласты.
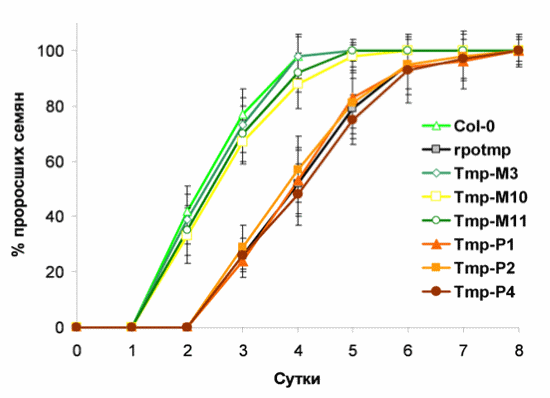
Семена линий Tmp-M (митохондриальная локализация RPOTmp) прорастают раньше, чем семена мутантной линии rpotmp, при этом время прорастания семян линий Tmp-P (хлоропластная локализация RPOTmp) не отличается от характерного для мутантных растений.

Фенотипический облик трансгенных растений Tmp-М в сравнении с исходными мутантами rpotmp и растениями дикого типа (Col-0).
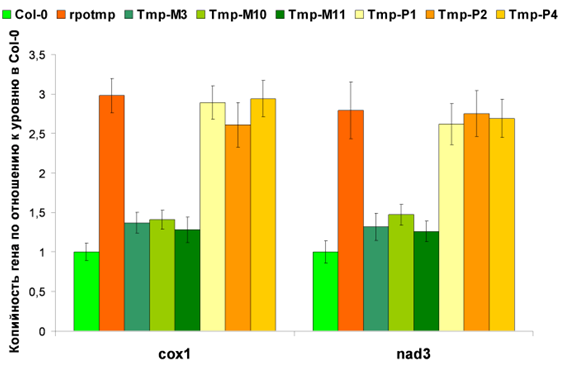
Количество копий митохондриальных генов, увеличенное в мутанте rpotmp, восстанавливается почти до уровня дикого типа в линиях Tmp-M, но не Tmp-P.
Изучение мутантных растений, экспрессирующих RPOTmp хлоропластной локализации, не выявило различий между ними и исходными мутантами. Мутанты rpotmp, экспрессирующие RPOTmp митохондриальной локализации, напротив, проявляли фенотип, практически не отличимый от нормального, а уровень экспрессии и копийность митохондриальных генов были близки к уровням, наблюдаемым в растениях дикого типа (Tarasenko et al., 2016).
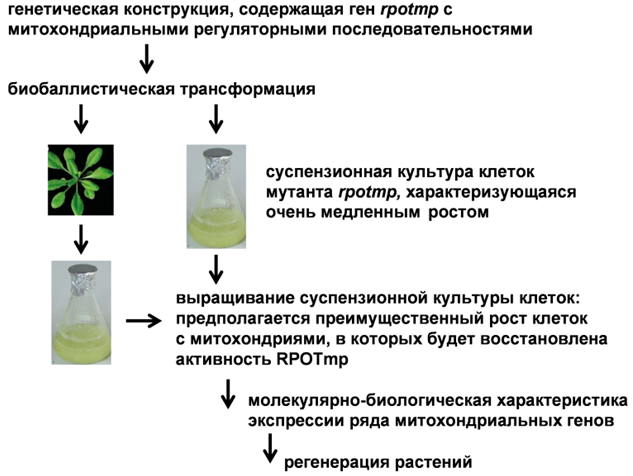
Предполагаемая схема трансформации митохондриального генома мутантной линии арабидопсиса rpotmp.
Полученные данные свидетельствуют в пользу представлений о том, что белок RPOTmp играет важную роль в митохондриях, но не в хлоропластах, а также служат указанием на возможность использования растений rpotmp и генетической конструкции, несущей ген rpotmp, в качестве системы для трансформации митохондриального генома.

